DIAGRAMA DE FASES
En termodinámica y ciencia de materiales se denomina diagrama de fase o diagrama de estado de la materia, a la representación entre diferentes estados de la materia, en función de variables elegidas para facilitar el estudio del mismo. Cuando en una de estas representaciones todas las fases corresponden a estados de agregación diferentes se suele denominar diagrama de cambio de estado.
Los diagramas de equilibrio pueden tener diferentes concentraciones de materiales que forma una aleación a distintas temperaturas. Dichas temperaturas van desde la temperatura por encima de la cual un material está en fase líquida hasta la temperatura ambiente y en que generalmente los materiales están en estado sólido.
SUSTANCIAS PURAS
La materia está formada por átomos y moléculas. Los átomos son los más simples y los diferentes tipos de átomos están clasificados en la tabla periódica de los elementos. No olvidemos que un elemento es una sustancia que está formada toda por átomos iguales. El Hierro (símbolo Fe) está formado por átomos de hierro. Los átomos también se pueden agrupar formando lo que llamamos moléculas. Una molécula es la unión de varios átomos. Una molécula de agua pura H2O está formada por dos átomos de Hidrógeno (H) con uno de oxígeno (O).
Bien, dicho esto si queremos clasificar los diferentes tipos de materia lo haremos en función de como está formada. Según esté formada la materia tenemos dos grandes grupos, uno llamado Sustancias Puras y otro llamado Mezclas.
Sustancias Puras : Tipo de materia que está formada por átomos o moléculas todas iguales. A su vez estas se clasifican en sustancias puras simples y compuestos químicos. Para definir estos dos tipos de sustancias puras hay dos formas. Empecemos por la primera.
Sustancias Puras Simples: están formadas por átomos todos iguales o moléculas con átomos iguales. Ojo hay elementos como el oxígeno que si lo miramos por un microscopio está formado todo por átomos de oxígeno iguales, pero agrupados de dos en dos, es decir agrupado en moléculas de O2, pero como los átomos que forman estas moléculas son iguales (oxigeno-oxigeno) se considera sustancia pura simple. Si tenemos un trozo de hierro puro y lo miramos por el microscopio veremos que está formado solo por átomos de Hierro, por lo tanto también es una sustancia pura simple. Las sustancias puras simples también se pueden llamar elementos, ya que las conocidas forman la llamada tabla periódica de los elementos.
Compuestos Químicos : Formados por moléculas todas iguales. En este caso los átomos que forman las moléculas tienen que ser diferentes. Por ejemplo el agua, cuya fórmula es H2O, moléculas todas iguales, y cada molécula estará formada por dos átomos de hidrógeno (H) y uno de oxígeno (O).
Ahora vamos con la segunda forma de definirlas. Como el comportamiento químico de estos dos tipos de sustancias puras también es diferente podríamos definir los dos tipos de sustancias puras en función de su comportamiento químico.
Sustancias Puras Simples o elementos: son aquellas sustancias puras que no se pueden descomponer en otras más simples.
Compuestos químicos : son aquellas sustancias puras que pueden descomponerse en otras más simples por métodos químicos (mediante reacciones).
Veamos un ejemplo. El agua pura se puede descomponer mediante una reacción química en hidrógeno por un lado y oxígeno por otro. Pero el hidrógeno o el oxígeno no podríamos descomponerlos de ninguna forma en otra sustancia más simple. Por eso el agua pura sería un compuesto químico y el oxígeno y el hidrógeno son sustancias puras simples o elementos químicos.
SOLUCIONES QUÍMICAS
Las soluciones químicas pueden tener cualquier estado físico. Las más comunes son las líquidas, en donde el soluto es un sólido agregado al solvente líquido. Generalmente agua en la mayoría de los ejemplos. También hay soluciones gaseosas, o de gases en líquidos, como el oxígeno en agua. Las aleaciones son un ejemplo de soluciones de sólidos en sólidos.
La capacidad que tiene un soluto de disolverse en un solvente depende mucho de la temperatura y de las propiedades químicas de ambos. Por ejemplo, los solventes polares como el agua y el alcohol, están preparados para disolver a solutos iónicos como la mayoría de los compuestos inorgánicos, sales, óxidos, hidróxidos. Pero no disolverán a sustancias como el aceite. Pero este si podrá disolverse en otros solventes como los solventes orgánicos no polares.
SOLUTO - DISOLVENTE
Las Soluciones son sistemas homogéneos (iguales propiedades físicas y químicas en toda su masa), que están constituidas básicamente por dos componentes llamados Solvente y Soluto.Solvente básicamente es la cantidad mayoritaria de la solución, es aquello que contiene al soluto. Por ejemplo si pensamos en agua salada, el agua es el solvente y la sal representa el soluto.También algunos lo dicen como Soluto y Disolvente y a la Solución le dicen Disolución. En muchos casos podemos encontrar que un solvente contiene dos o más solutos, por ejemplo agua con sal y azúcar. Este concepto también es extensible a gases y sólidos.
Todos estamos en contacto diario con las soluciones químicas (jugos, refrescos, café, rio, mar, etc.). Y las plantas también, cuando sus raíces contactan la solución del suelo.
Cuando se introduce un poquito de azúcar dentro de un vaso lleno de agua, se observa que la azúcar desaparece sin dejar rastro de su presencia en el agua. Lo primero que se piensa es que hubo una combinación química, es decir, que las dos sustancias reaccionaron químicamente, lo que significa que hubo un reacomodo entre sus átomos. Sin embargo, simplemente sucedió que ambas sustancias se combinaron físicamente y formaron una mezcla homogénea o solución.
A la unión de dos o más sustancias se le conoce como combinación; estas combinaciones pue- den ser de dos tipos: combinaciones físicas y combinaciones químicas. Las combinaciones quími cas se conocen como enlaces químicos; estas combinaciones consisten en la unión de dos o más sustancias, cuyos átomos o moléculas se unen entre sí mediante fuerzas llamadas enlaces quími cos, y sólo mediante procedimientos químicos es posible separar tales sustancias combinadas; por ejemplo, al combinar agua (H2O) con cal viva (CaO), entonces se forma el Hidróxido de Cal cio. Aquí hubo una combinación química, puesto que los átomos del agua y la cal se reacomoda- ron originando así el Hidróxido de Calcio.
Las combinaciones físicas se conocen como mezclas, las que son de dos tipos: heterogéneas y homogéneas. En las mezclas heterogéneas, las sustancias que se mezclan no se distribuyen uni- formemente, por lo que se pueden distinguir ambas sustancias mezcladas; en las mezclas homo géneas, las sustancias mezcladas si se distribuyen uniformemente, y toda la mezcla se observa como si fuese una sola sustancia, es decir, las sustancias no se pueden distinguir una de la otra, pues han formado una sola fase(homogénea). Un ejemplo lo constituyen los perfumes, que con- tienen agua, alcohol y esencia, y sin embargo ninguna de las tres sustancias puede distinguirse;
a este tipo de mezclas se les denomina disoluciones* o simplemente soluciones.
Un ejemplo claro de solución es el agua salada, que contiene agua y sal. Tales sustancias se encuentran mezcladas o revueltas homogéneamente, de tal forma que no se puede distinguir u- na de la otra, y sin embargo no existe algún enlace químico entre ambas; simplemente el agua di solvió a la sal de mesa, por lo cual se dice que las mezclas son combinaciones que pueden frac -cionarse o separarse en sus distintos componentes por métodos físicos.
Concepto de solución
Una solución es una mezcla homogénea de dos o más sustancias. Estas sustancias pueden ser sólidas, líquidas y gaseosas.
Las soluciones, también llamadas disoluciones, son uniones físicas entre dos o más sustancias que originan una mezcla de tipo homogénea, la que presenta uniformidad en todas sus partes.
Importancia de las soluciones
- La materia se presenta con mayor frecuencia en la naturaleza en forma de soluciones, dentro de las cuales se llevan a cabo la gran mayoría de losprocesos químicos.
- Muchas de estas mezclas son soluciones y todas ellas rodean a los seres vivos (agua de mar, de río, suelo, aire, sustancias comerciales, etc.), por lo que nuestra existencia depende de las mismas, en menor o mayor grado. Además, en el interior de una persona existen soluciones tales como la saliva,sangre, orina, ácidos y bases diluidos, etc.
- La industria genera infinidad de soluciones en forma de drogas, medicinas, desinfectantes, bebidas gaseosas, cosméticos, etc.
Partes de una solución (componentes)
Hay dos aspectos importantes en el tema de las soluciones: el de las partes o sustancias que las forman y el de la cantidad de cada una de estas partes, principalmente el soluto. Veremos el primer aspecto.
Toda solución está formada por dos partes: el soluto y el solvente. El soluto es la sustancia que se disuelve y que está en menor cantidad en una solución; el solvente es la sustancia que se encuentra en mayor cantidad y es la que di - suelve al soluto. La solución resulta de mezclar el soluto con el solvente, y estas sustancias mezcladas tan solo experimentan un cambio físico, específica -mente el solvente (aspecto, puntos de fusión, ebullición y congelación, etc.).
En ocasiones, existe un solvente y varios solutos, y a veces varios solventes y solutos; las partículas del soluto son moléculas o iones y se encuentran dispersas y atrapadas por las moléculas del solvente, que son más abundantes y de mayor tamaño molecular.
Con respecto al solvente, se reconoce al agua como el solvente universal o más popular; cuando el agua actúa como solvente en las soluciones, entonces estas se denominan "soluciones acuosas".Sin embargo, no todas las sustancias se disuelven en el agua, sino que lo hacen en otros tipos de solventes (alcohol, etc.), por lo que las soluciones pueden ser acuosas (cuando el agua es el solven te) y no-acuosas (cuando el solvente es otra sustancia).
Estados de las soluciones
Se sabe que toda la materia del mundo se presenta fundamentalmente en 3 estados físicos o de agregación, y en igual modo se presentan las soluciones en la naturaleza, así:
a. Soluciones sólidas. Todas las aleaciones, como el latón (cobre con zinc), bronce (cobre con es
b. Soluciones líquidas. Como
- Sólido en líquido: sal disuelta en agua; azúcar disuelta en agua, etc.
- Líquido en líquido: alcohol disuelto en agua, etc.
c. Soluciones gaseosas. Como el aire, que es una solución formada por varios gases (solutos), ta
les como el dióxido de carbono, oxígeno y argón, los cuales están disueltos en otro gas llama –
do nitrógeno (solvente). Otros ejemplos son la niebla y el humo.
Así, las soluciones pueden ser sólidas, liquidas y gaseosas, y estar formadas por gases (soluto) en gases (solvente), gases en líquidos, sólidos en líquidos, líquidos en líquidos y sólidos en só- lidos. Esto es que, el soluto puede ser un gas, un líquido o un sólido, e igual el solvente.
SOLUBILIDAD
Cantidad de un material que se disolverá
completamente en un segundo material, sin crear una segunda fase.
Se pueden presentar dos tipos de
solubilidad:
•Solubilidad Ilimitada:
Condición que se presenta cuando la cantidad de un material que se disolverá en
otro es ilimitada, sin crear una segunda fase.
•Solubilidad Limitada: Condición
referente a que sólo se puede disolver una cantidad máxima de un material
soluto en un material solvente.
ELECTRONEGATIVIDAD
La electronegatividad es una medida de la capacidad de un átomo (o de manera menos frecuente de un grupo funcional) para atraer a los electrones, cuando forma un enlace químico en una molécula.1 También debemos considerar la distribución de densidad electrónica alrededor de un átomo determinado frente a otros distintos, tanto en una especie molecular como en sistemas o especies no moleculares. El flúor es el elemento con más electronegatividad, el Francio es el elemento con menos electronegatividad.
La electronegatividad de un átomo determinado está afectada fundamentalmente por dos magnitudes: su masa atómica y la distancia promedio de los electrones de valenciacon respecto al núcleo atómico. Esta propiedad se ha podido correlacionar con otras propiedades atómicas y moleculares. Fue Linus Pauling el investigador que propuso esta magnitud por primera vez en el año 1932, como un desarrollo más de su teoría del enlace de valencia.2 La electronegatividad no se puede medir experimentalmente de manera directa como, por ejemplo, la energía de ionización, pero se puede determinar de manera indirecta efectuando cálculos a partir de otras propiedades atómicas o moleculares.
Se han propuesto distintos métodos para su determinación y aunque hay pequeñas diferencias entre los resultados obtenidos todos los métodos muestran la misma tendencia periódica entre los elementos.
El procedimiento de cálculo más común es el inicialmente propuesto por Pauling. El resultado obtenido mediante este procedimiento es un número adimensional que se incluye dentro de la escala de Pauling. Esta escala varía entre 0,7 para el elemento menos electronegativo y 4,0 para el mayor.
Es interesante señalar que la electronegatividad no es estrictamente una propiedad atómica, pues se refiere a un átomo dentro de una molécula3 y, por tanto, puede variar ligeramente cuando varía el "entorno"4 de un mismo átomo en distintos enlaces de distintas moléculas. La propiedad equivalente de la electronegatividad para un átomo aislado sería la afinidad electrónica o electroafinidad.
Dos átomos con electronegatividades muy diferentes forman un enlace iónico. Pares de átomos con diferencias pequeñas de electronegatividad forman enlaces covalentes polares con la carga negativa en el átomo de mayor electronegatividad.
ALEACIÓN
Una aleación es una combinación de propiedades metálicas, que está compuesta de dos o más elementos metálicos.
Las aleaciones están constituidas por elementos metálicos como Fe (hierro), Al (aluminio), Cu (cobre), Pb (plomo), ejemplos concretos de una amplia gama de metales que se pueden alear. El elemento aleante puede ser no metálico, como: P (fósforo), C (carbono), Si (silicio), S (azufre), As (arsénico).
Mayoritariamente las aleaciones son consideradas mezclas, al no producirse enlaces estables entre los átomos de los elementosinvolucrados. Excepcionalmente, algunas aleaciones generan compuestos químicos.

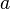 ,
,  y
y  , de los tres vectores, y los ángulos
, de los tres vectores, y los ángulos  ,
, 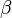 y
y 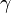 que forman entre sí. Estos tres vectores forman una base del espacio tridimensional, de tal manera que las coordenadas de cada uno de los puntos de la red se pueden obtener a partir de ellos por combinación lineal con los coeficientes enteros.
que forman entre sí. Estos tres vectores forman una base del espacio tridimensional, de tal manera que las coordenadas de cada uno de los puntos de la red se pueden obtener a partir de ellos por combinación lineal con los coeficientes enteros.